CÁCH VIẾT LIÊN KẾT CỘNG HÓA TRỊ
Liên kết cộng hóa trị và liên kết ion là phần kiến thức quan trọng trong chương trình hóa học lớp 10. Vậy liên kết cộng hóa trị là gì? Chuyên đề liên kết cộng hóa trị cần nắm được kiến thức gì? Liên kết cộng hóa trị không cực là gì? Liên kết cộng hóa trị có cực là gì? Bài tập ví dụ về liên kết cộng hóa trị? Trong bài viết sau, hãy cùng trangnhacaiuytin.com tìm hiểu về chủ đề trên nhé!
Mục lục
1 Sự hình thành liên kết cộng hóa trị bằng cặp electron chung2 Tìm hiểu liên kết cộng hoá trị là gì?3 Liên kết cộng hóa trị có cực và liên kết cộng hóa trị không cực5 Tính chất của các chất có liên kết cộng hoá trị6 Cách viết công thức cấu tạo của các hợp chất cộng hóa trị khi biết công thức phân tửSự hình thành liên kết cộng hóa trị bằng cặp electron chung
Sự hình thành phân tử đơn chất
Sự hình thành phân tử Hidro \(H_{2}\)H : \(1s^{1}\)
Sự hình thành phân tử \(H_{2}\) : \(H. + H. \rightarrow H : H\)
Mỗi chấm bên kí hiệu nguyên tố biểu diễn một electron ở lớp ngoài cùng, H:H được gọi là công thức electron. Thay hai chấm bằng 1 gạch, ta có H – H gọi là công thức cấu tạo.Giữa 2 nguyên tử hiđro có 1 cặp electron liên kết biểu thị bằng một gạch (-), đó là liên kết đơn.Bạn đang xem: Cách viết liên kết cộng hóa trị
Sự hình thành phân tử \(N_{2}\)
\(N: 1s^{2}2s^{2}2p^{3}\)
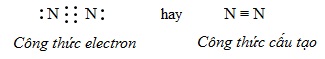
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng 3 gạch ( \(\equiv\) ), đó là liên kết 3. Liên kết 3 bền hơn liên kết đôi
Tìm hiểu liên kết cộng hoá trị là gì?
Liên kết cộng hóa trị là gì?
Liên kết cộng hoá trị là liên kết được tạo nên giữa 2 nguyên tử bằng 1 hay nhiều cặp electron dùng chung
Mỗi cặp electron chung tạo nên 1 liên kết cộng hoá trị, nên ta có liên kết đơn (trong phân tử \(H_{2}\)) , liên kết ba (trong phân tử \(N_{2}\))Liên kết trong các phân tử \(H_{2}\), \(N_{2}\) tạo nên từ 2 nguyên tử của cùng 1 nguyên tố (có độ âm điện như nhau) , do đó liên kết trong các phân tử đó không phân cực . Đó là liên kết cộng hoá trị không phân cựcSự hình thành phân tử hợp chất
Sự hình thành phân tử HCl
Trong phân tử hiđro clorua, mỗi nguyên tử (H và Cl) góp 1 electron tạo thành 1 cặp electron chung để tạo nên một liên kết cộng hóa trị. Độ âm điện của Clo là 3,16 lớn hơn độ âm điện của hiđro là 2,20 nên cặp electron liên kết bị lệch về phía Clo, liên kết cộng hóa trị này bị phân cực.

Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
Sự hình thành phân tử khí cacbonic \(CO_{2}\) (có cấu tạo thẳng)
Cấu hình electron nguyên tử của C (Z=6) là \(1s^{2}2s^{2}2p^{2}\), nguyên tử cacbon có 44 electron ở lớp ngoài cùngCấu hình electron nguyên tử của O (Z=8) là \(1s^{2}2s^{2}2p^{4}\), nguyên tử oxi có 66 electron ở lớp ngoài cùngTrong phân tử \(CO_{2}\), nguyên tử C nằm giữa 2 nguyên tử O và góp chung với mỗi nguyên tử O hai electron, mỗi nguyên tử O góp chúng với nguyên tử C hai electron tạo ra 2 liên kết đôi.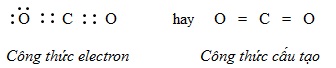
Kết luận:
Theo công thức electron, mỗi nguyên tử C hay O đều có 8e ở lớp ngoài cùng đạt cấu hình của khí hiếm nên phân tử \(CO_{2}\) bền vững
Liên kết cho – nhận
Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho – nhận.

Liên kết cộng hóa trị có cực và liên kết cộng hóa trị không cực
Liên kết cộng hóa trị có cực là gì?
Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử (có độ âm điện lớn hơn) gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.Trong công thức electron của phân tử có cực, người ta thường đặt cặp electron chung lệch về phía ký hiệu của nguyên tử có độ âm điện lớn hơn.Liên kết cộng hóa trị không cực là gì?
Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử liên kết ta có liên kết cộng hóa trị không cực.Xem thêm: Cách Tỉa Hoa Hồng Từ Cà Chua Trang Trí Cho Món Ăn Đãi Tiệc Đẹp Mắt
Liên kết ion
Trong phân tử, nếu cặp electron chung lệch hẳn về 1 nguyên tử, ta sẽ có liên kết ion.Sự giống nhau và khác nhau giữa cộng hóa trị không cực, cộng hóa trị có cực và liên kết ion
Giống nhau: Các nguyên tử kết hợp với nhau tạo ra mỗi nguyên tử lớp electron ngoài cùng bền bững giống cấu trúc của khí hiếm (quy tắc bát tử).Khác nhau:
Tính chất của các chất có liên kết cộng hoá trị
Trạng thái
Các chất mà phân tử chỉ có liên kết cộng hoá trị có thể là :
Các chất rắn : đường , lưu huỳnh , iot…Các chất lỏng : nước , rượu , xăng , dầu…Các chất khí : khí cacbonic , khí clo , khí hidro …Tính tan
Các chất có cực như rượu etylic , đường ,… tan nhiều trong dung môi có cực như nước.Phần lớn các chất không cực như lưu huỳnh , iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen , cacbon tetra clorua ,…Nói chung các chất có liên kết cộng hoá trị không cực không dẫn điện ở mọi trạng thái.
Cách viết công thức cấu tạo của các hợp chất cộng hóa trị khi biết công thức phân tử
Phương pháp
Để viết công thức các hợp chất vô cơ khi biết công thức phân tử của chúng, ta có thể thực hiện các bước sau:
Bước 1: Xác định tổng số electron mà các nguyên tử của từng nguyên tố cần cho hay nhận để đạt cấu hình bền vững theo nguyên tắc bát tử. Đối với kim loại thì tính số electron nhận thêm. Ngược lại, đối với phi kim thì tính số electron nhường đi.Bước 2: Xác định tổng số electron của tất cả các nguyên tố cần để đath cấu hình bền vững theo nguyên tắc bát tử (xét tổng của toàn bộ phân tử)Bước 3: Tính số liên kết tồn tại trong phân tử hợp chất đó. Vì mỗi liên kết cộng hóa trị là sự góp chung hai nguyên tử \(\rightarrow\) mỗi liên kết chứa 2 electron. Ta có số liên kết = (tổng số electron mà phân tử cần để đảm bảo quy tắc bát tử) : 2Bước 4: Sắp xếp các nguyên tử sao cho đúng trật tự của chúng và tổng số liên kết phải bằng tổng số liên kết đã tính ở trên.Xem thêm: Cách Bấm Máy Tính Định Thức Của Ma Trận, Tính Toán Ma Trận Bằng Máy Tính Casio Fx
Ví dụ cụ thể
Viết công thức cấu tạo của \(H_{2}SO_{4}\)
Cách giải:
Ta có:
1 nguyên tử H cần thêm 1e để thỏa mãn quy tắc bát tử, nhị tử. Mà phân tử \(H_{2}SO_{4}\) có hai nguyên tử H nên cần 2e.1 nguyên tử S cần 2e1 nguyên tử O cần 2e \(\rightarrow\) 4 nguyên tử cần 8eTổng số e mà 2 nguyên tử H, 4 nguyên tử O, 1 nguyên tử S cần là:
2 + 2 + 8 = 12e
Tổng số liên kết có trong phân tử \(H_{2}SO_{4}\)
12 : 2 = 6 liên kết
Vì trong phân tử axit có oxi luôn tồn tại nhóm H-O-. Mà phân tử \(H_{2}SO_{4}\) có 2 nguyên tử H nên có 2 nhóm HO-
Viết các liên kết giữa các nhóm H-O- với S trước rồi tính số liên kết cho nhận.
Vậy công thức cấu tạo của \(H_{2}SO_{4}\) là:
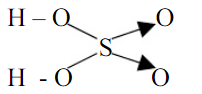
Như vậy, bài viết trên đây của trangnhacaiuytin.com đã giúp bạn tổng hợp kiến thức về chuyên đề liên kết cộng hóa trị. Hy vọng với những thông tin trong bài viết, bạn đã có thể trả lời được liên kết cộng hóa trị có cực là gì, liên kết cộng hóa trị không cực là gì, cách vẽ liên kết cộng hóa trị cũng như khái niệm tổng quát liên kết cộng hóa trị là gì. Chúc bạn luôn học tốt!



















